-
CÓDIGO
- PG-1003
- PG-1004
- PG-1009
- PG-1010
- BG-1010
- CP-1000
- DE-1010
-
DESCRIPCIÓN
- Tiras de Acetato de Celulosa
- Tiras de Acetato de Celulosa
- Tiras de Acetato de Celulosa
- Tiras de Acetato de Celulosa
- Buffer Barbital Veronal
- Colorante Amido Black
- Decolorante Progel
-
UNIDADES
- 1O tiras
- 25 tiras
- 1O tiras
- 25 tiras
- 1 litro
- 1 litro
- 1 litro
-
CM
- 2,5x17 cm.
- 2,5x17 cm.
- 5,7x14 cm.
- 5,7x14 cm.













Reactivos y material necesarios
• Progel. Tiras de acetato de celulosa gelificado-Ver presentaciones
• Buffer Barbital (Veronal) BG 1000/1010-BG 1000/1010
• Solución Colorante Amido Black CP 1000
• Solución Decolorante DE 1000/1010
• Fuente y Cuba electroforesis
• Aplicador de muestra
• PROSOFT. Software cuantificar las fracciones empleando escáner común y tiras no transparentadas.
PROCEDIMIENTO
Paso 1
• Abrir el sobre, retirar las tiras necesarias, conservar el resto en su sobre original o recipiente cerrado con una concentración de Metanol entre 20 y 40%.

PROCEDIMIENTO
Paso 2
• Previo a su utilización, equilibrar en buffer Barbital nuevo10-20 minutos. No emplear la cuba de electroforesis ni el buffer de corrida para incubar, ya que el metanol absorbido en las tiras, altera el pH y fuerza iónica del buffer de corrida y restos de acetato pueden adherirse a los electrodos.
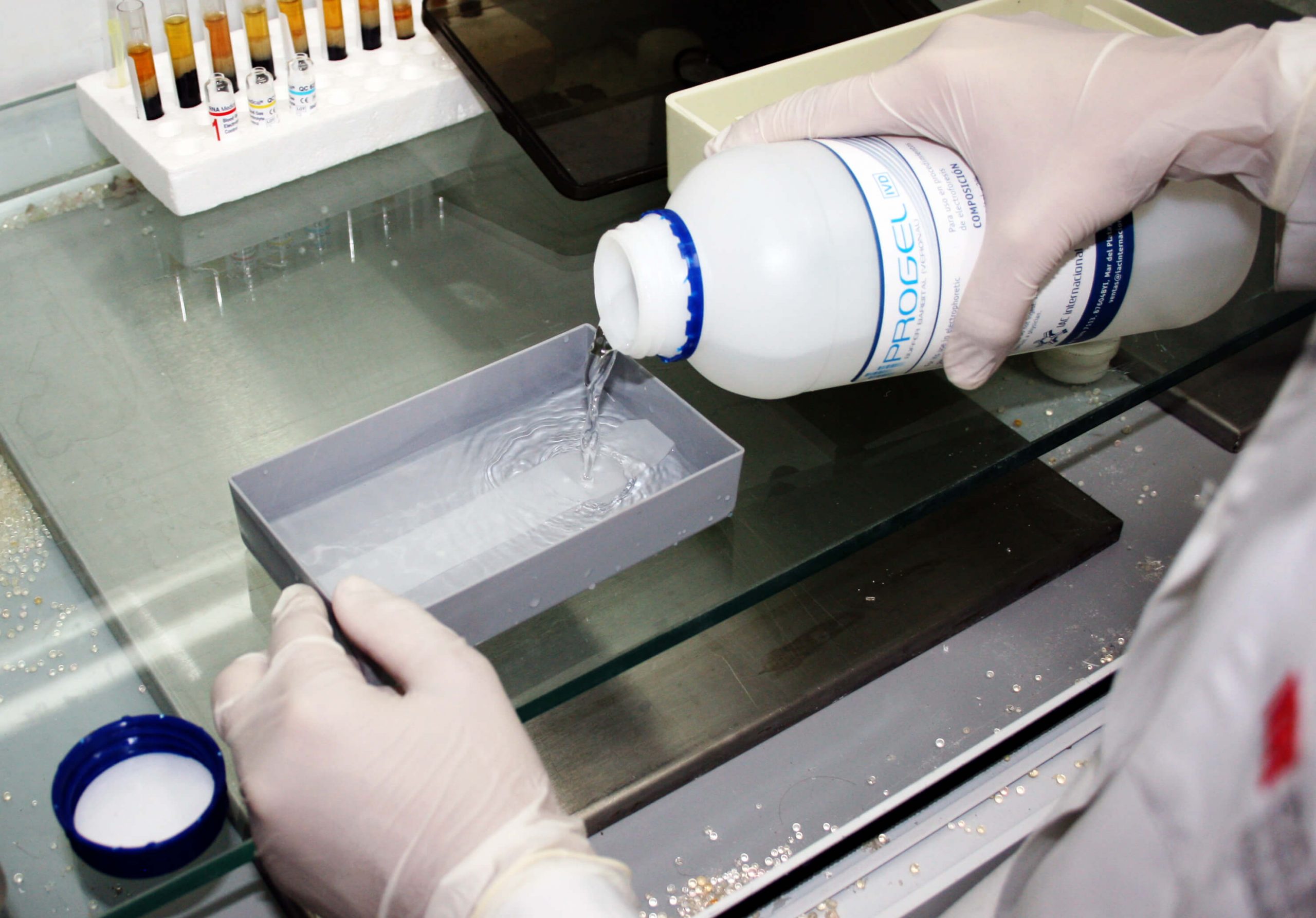
PROCEDIMIENTO
Paso 3
Secar cada tira, individualmente (rollo absorbente de papel de cocina es aceptable). La formulación de PROGEL permite mantener las tiras en contacto con el aire por periodos superiores a 15 minutos sin que sufran deterioro alguno. Esto da mayor margen de maniobra al operador durante el procedimiento

PROCEDIMIENTO
Paso 4
Aplicar las muestras de acuerdo a las instrucciones de uso de su sembrador. La tira debe usarse con el lado opaco hacia arriba (el extremo cortado, abajo a la derecha).
Muestra: suero (no emplear plasma). En el caso de utilizar otras muestras biológicas, clarificar previamente por centrifugación. De ser necesario concentrar (el límite de sensibilidad del método es 0,03 mg/dl).
La utilización de materiales biológicos distintos a suero humano, debe ser validada por el profesional responsable.

PROCEDIMIENTO
Paso 5
Agregar el buffer Barbital hasta el nivel indicado en la cuba de electroforesis.
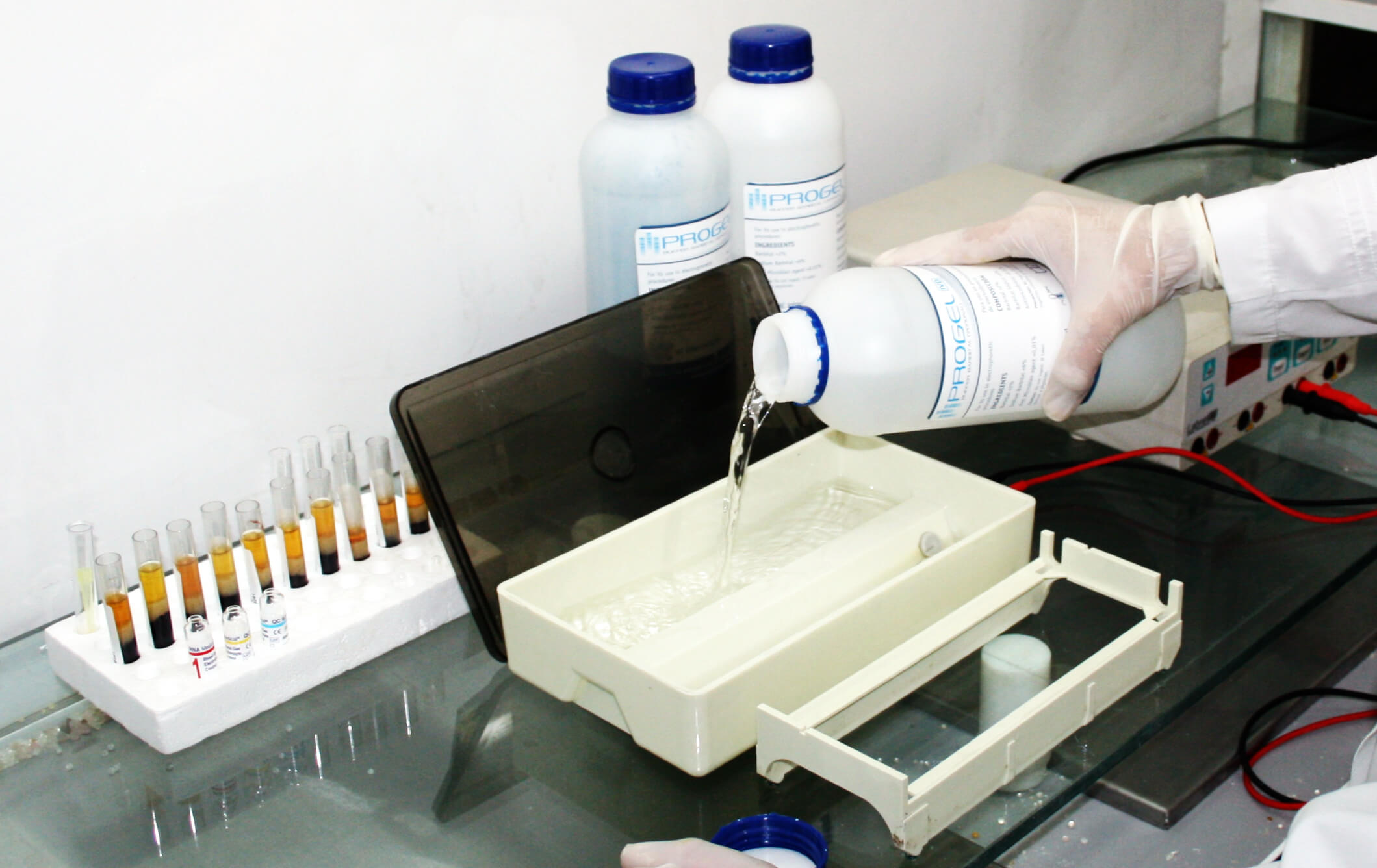
PROCEDIMIENTO
Paso 6
De ser posible, inclinar, como muestra la figura, para equilibrar el volumen de líquido en ambos lados de la misma.

PROCEDIMIENTO
Paso 7
Colocar las tiras en la cuba formando un “puente” simétrico entre ánodo y cátodo, de manera que los extremos sumergidos en el buffer tengan aproximadamente la misma longitud. Tapar y correr inmediatamente para evitar la difusión de la muestra.

PROCEDIMIENTO
Paso 9
Colorear por espacio de 5 a 30 segundos en colorante Amido Black- Amido Black CP 1000. Este colorante ha sido formulado específicamente para PROGEL:
-Permite periodos de coloración cortos.
-Disminuye la coloración inespecífica y la precipitación de proteínas entre las fracciones lo que permite obtener una mayor resolución y separación clara de alfa1/alfa2 y beta1/beta2
-Decoloración más rápida.
Al efectuar la coloración, se recomienda sostener las tiras manualmente para evitar la tinción de los extremos y disminuir así la cantidad de colorante retenido.

PROCEDIMIENTO
Paso 8
Antes de continuar con el siguiente paso, asegúrese de conocer el funcionamiento de la fuente de poder y cuba. Bajo ninguna circunstancia toque ni abra la cuba mientras está conectada a la red eléctrica. Luego de finalizada la corrida y desconectada fuente de poder, se recomienda esperar un par de minutos para permitir la disipación de eventual corriente estática
Correr bajo un amperaje constante de 3 mA por cada tira de 2,5x17 cm o proporcionalmente para tiras mas anchas.
Aplicar un Voltaje constante de entre 150 V/ 30ª 60 minutos hasta 200 V /22 minutos (1-1,5 mA/cm). Es decir, aproximadamente 3-4 mA por cada tira de 2,5*17).
Cada laboratorio debe determinar las condiciones óptimas de corrida de acuerdo a su equipamiento (fuentes, cuba, electrodos, etc.).
Se recomienda no reutilizar el Buffer, pero en caso de hacerlo mezclar previamente los depósitos aniónico y catiónico, ya que el pH de cada uno será diferente luego de la corrida.

PROCEDIMIENTO
Paso 11
Evaluación:
La inspección visual de la tira, es el paso más importante en la evaluación de una proteinograma electroforético
El escaneo posterior cuantifica, pero no reemplaza al ojo del profesional experimentado.

PROCEDIMIENTO
Paso 10
Decoloración: enjuagar una vez con decolorante usado y varias veces con sucesivos cambios solución decolorante nueva (es preferible efectuar varios cambios de volúmenes pequeños a pocos cambios de grandes volúmenes).
De ser posible agitar en forma permanente.




PROCEDIMIENTO
Paso 12
Cuantificación. Nuestra Empresa ha desarrollado PROSOFT un software de digitalización y procesamiento de imágenes, que permite analizar, modificar y cuantificar los resultados, empleando un simple escáner comercial y tiras sin transparentizar. Consulte por la versión beta del mismo

ESTE PROUCTO SE ENCUENTRA FUERA DE SERVICIO