Características

Fundamentos del método
Cuando el antigeno Ag, presente en la muestra, penetra en la superficie del agar, reacciona con el anticuerpo especifico, produciendo un precipitado circular que se redisuelve y forma nuevamente a mayor distancia del punto de siembra. Esto se debe a que en los primeros momentos, la reaccion se desarrolla en la zona de exceso de anticuerpo.Este proceso se repite continuamente durante las primeras 48 hs, hasta que finalmente se alcanza el punto de equivalencia Ag-Acpo y
la difusión cesa. En este momento, el área del precipitado, incluyendo el orificio de siembra resulta directamente proporcional a la cantidad de antígeno (x) presente en la muestra.En la practica, el area del ppdo. Se reemplaza por el diametro al cuadrado d². Por lo que:
d²=mx+d0
Donde m es la pendiente de la curva de calibración y d0 la ordenada al origen.
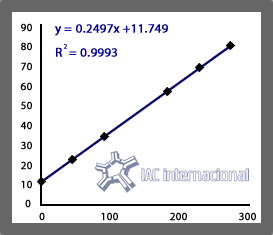
Fig 1 Ej.Placa C3; m=0,2947; d0=11,749La pendiente m de la curva de calibracion es funcion de:
-La especificidad del antisuero (IgA, IgG, Transferrina etc)
-Distintos lotes de la misma placa
-Volumen de muestra aplicado
Es decir que la pendiente de la curva de calibracion m sera la misma para todas las placas del mismo lote y especificidad si se mantiene el volumen de muestra.
El valor de d0 (ordenada al origen) es funcion del diametro del pocillo y del volumen de la muestra e independiente de la especificidad del antisuero.
Como el diámetro del pocillo es el mismo para todas las placas RID Plate (2,7 mm), aquí también la única variable que afecta a d0 es el volumen de muestra y esto ( a diferencia de m) es independiente de la especificidad y lote de la placa fig 2.
Un estudio de 80 lotes de RID Plate de distinta especificidad, dio un valor medio de d0 de 11,87 mm2.Este valor se puede tomar como referencia siempre que el volumen de muestra sea de exactamente 5 μl.
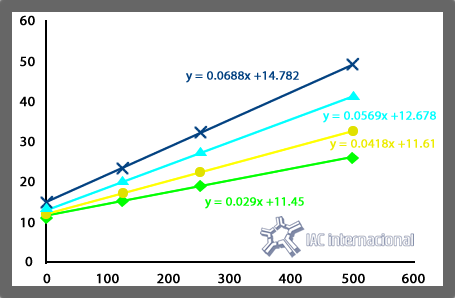
Fig 2. Variacion de la pendiente y en menor medida de la ordenada en curvas de calibracion de la misma placa de IgA en funcion del volumen de muestra ap;icado (3,4,5 y 6 μl)
Conclusión
El diametro en el punto de equivalencia es funcion de la relacion antigeno/anticuerpo.
Como la cantidad de anticuerpo para todas las placas de un lote dado es el mismo, la unica variable que tiene incidencia en la pendiente de la curva de calibracion es el volumen de la muestra.
Por lo tanto, la exactitud de los resultados obtenidos empleando la Tabla de Valores de Referencia provista con cada placa, depende de la exactitud del volumen de muestra aplicado ya que este afecta a la pendiente y en menor medida a la ordenada al origen.

Reseña Histórica
El surgimiento de métodos inmuno cromatográficos, a mediados del siglo pasado, permitió el aislamiento de proteínas humanas con alto grado de pureza. Como resultado de ello fue posible obtener antisueros policlonales de alto titulo y especificidad, lo que finalmente condujo al desarrollo de diversas metodologías para el análisis cuali y cuantitativo de proteínas plasmaticas. La Inmunodifusión Radial Cuantitativa fue el primer procedimiento analitico que permitio cuantificar en forma sencilla, precisa y exacta la concentracion de proteinas especificas en liquidos biologicos. *Por su simplicidad, rapidez y escaso requerimiento tecnico, continua hoy siendo el metodo de referencia y la alternativa de eleccion en pequeños y medianos laboratorios.
El método se basa en la reacción entre un antígeno y su correspondiente anticuerpo, disuelto en una matriz semisólida de agar. Cuando el antígeno presente en la muestra o control, se introduce en un pocillo cavado en el gel que contiene el anticuerpo, se forma un precipitado visible. El mismo tiene forma de anillo que se va expandiendo en la medida que el antígeno difunde radialmente desde el punto de siembra. Al alcanzar el punto de equivalencia, la difusión se detiene y en ese momento el área del precipitado es directamente proporcional a la cantidad de antígeno presente en la muestra.
* Mancini G., Carbonara A. O. and Heremans J. F., Immunochemistry, 2, 235 (1965).